摘要:目的:探究超微血管成像(SMI)联合实时剪切波弹性成像(SWE)对乳腺肿瘤良、恶性鉴别诊断效能的影响。方法:选取2018-02~2019-01我院乳腺外科就诊的82例乳腺肿瘤患者作为研究对象,共94个病灶,经病理诊断确诊良性肿瘤57个,恶性肿瘤37个,均进行SMI、SWE检查,对比乳腺良恶性肿瘤弹性模量值[平均值(Emean)、标准差(SD)及与周围正常乳腺组织弹性模量比值(Ratio)]、mSMI血流分型,并以ROC曲线分析SMI联合SWE诊断效能。结果:乳腺恶性肿瘤Emean、Ra-tio及SD均较乳腺良性肿瘤高(P<0.05);乳腺恶性肿瘤灰阶模式(mSMI)血流分型多集中于II~III级,良性肿瘤多集中于0 ~I级,两种性质肿瘤mSMI血流分型相比,差异有统计学意义(P<0.05);ROC曲线分析结果显示,SMI、SWE联合诊断敏感度、特异度均高于SMI、SWE单一诊断敏感度、特异度,联合诊断AUC大于单一诊断AUC。结论:SMI联合SWE鉴别诊断乳腺肿瘤良、恶性,可相互补充,诊断效能较高。
关键词:乳腺肿瘤;肿瘤性质;实时剪切波弹性成像;超微血管成像;文章发表
乳腺癌作为女性最常见恶性肿瘤之一,近年来,受多种因素影响,发病率明显增长,且发病人群逐渐趋于年轻化,严重威胁女性身心健康,因此,早期诊断、治疗尤为关键。实时剪切波弹性成像(SWE)凭借其可定量评估病灶软硬程度,获取组织弹性绝对值的优势广泛应用于乳腺癌诊断中,并取得一定效果[1]。随着医疗机械的不断发展、改进,超微血管成像(SMI)逐渐应用于乳腺癌诊断中,其主要借助彩色多普勒原理,提取微血管与低速运动组织差异,实现微小血管与低速血流检测,且操作简便[2]。目前,临床上多单纯采用SWE或SMI诊断乳腺癌,关于二者联合应用较为鲜见。本研究联合采用SWE、SMI诊断乳腺肿瘤良恶性,评价其诊断效能,结果如下。
关键词:乳腺肿瘤;肿瘤性质;实时剪切波弹性成像;超微血管成像;文章发表
乳腺癌作为女性最常见恶性肿瘤之一,近年来,受多种因素影响,发病率明显增长,且发病人群逐渐趋于年轻化,严重威胁女性身心健康,因此,早期诊断、治疗尤为关键。实时剪切波弹性成像(SWE)凭借其可定量评估病灶软硬程度,获取组织弹性绝对值的优势广泛应用于乳腺癌诊断中,并取得一定效果[1]。随着医疗机械的不断发展、改进,超微血管成像(SMI)逐渐应用于乳腺癌诊断中,其主要借助彩色多普勒原理,提取微血管与低速运动组织差异,实现微小血管与低速血流检测,且操作简便[2]。目前,临床上多单纯采用SWE或SMI诊断乳腺癌,关于二者联合应用较为鲜见。本研究联合采用SWE、SMI诊断乳腺肿瘤良恶性,评价其诊断效能,结果如下。
1、 资料与方法
1. 1 临床资料
选取2018-02~2019-01我院乳腺外科就诊的82例乳腺肿瘤患者作为研究对象,共94个病灶,年龄24~76岁,平均(49.87±13.02)岁;病灶直径0.56~5.37cm,平均直径(2.97±1.15)cm;病灶性质:良性57个,恶性37个,均经病理诊断确诊。
1. 2 方法
采用彩色多普勒超声诊断仪(ToshibaAplio500型),线阵探头,频率5~14MHz,具有SWE、SMI两种成像功能;协助患者取仰卧位,充分暴露双侧乳房,常规超声检查记录、存储二维图像,测量肿瘤最大直径;切换至SWE模式,采用连续激发模式,量程0~180kPa,确定感兴趣区域,静置3s,采集弹性图像,测量肿瘤最大直径,以Q-Box获取肿瘤弹性模样值E(kPa):平均值(Emean)、标准差(SD)及与周围正常乳腺组织弹性模量比值(Ratio),重复测量3次,取均值。待SWE图像采集完成后,切换至SMI模式,调节取样框大小调整速度,控制于1.2cm/s左右。选择血流显示最丰富切面分别采集彩色模式(cSMI)、灰阶模式(mSMI)图像。
血流分级标准[3]:以病灶内未发现血流信号为0级;病灶内存在少量血流,可见1或2细短棒状或点状血管为I级;病灶内存在中量血流,可见3或4个点状或1支较长血管,血管长度超过或接近病灶半径为II级;病灶内存在多量血流,可见2支较长血管或5个以上点状血管病灶为III级。通常认为,血流0~I级为良性肿瘤,血流II~III级为恶性肿瘤。
1. 3 观察指标
(1)对比乳腺良恶性肿瘤弹性模量值。(2)对比乳腺良恶性肿瘤mSMI血流分型对比。(3)以ROC曲线分析SMI联合SWE诊断效能。
1. 4 统计学方法
采用SPSS24.0分析数据,计量资料用(xˉ±s)表示,t检验,计数资料用n(%)表示,χ2检验,等级资料采用Ridit检验,检验水准α=0.05。
选取2018-02~2019-01我院乳腺外科就诊的82例乳腺肿瘤患者作为研究对象,共94个病灶,年龄24~76岁,平均(49.87±13.02)岁;病灶直径0.56~5.37cm,平均直径(2.97±1.15)cm;病灶性质:良性57个,恶性37个,均经病理诊断确诊。
1. 2 方法
采用彩色多普勒超声诊断仪(ToshibaAplio500型),线阵探头,频率5~14MHz,具有SWE、SMI两种成像功能;协助患者取仰卧位,充分暴露双侧乳房,常规超声检查记录、存储二维图像,测量肿瘤最大直径;切换至SWE模式,采用连续激发模式,量程0~180kPa,确定感兴趣区域,静置3s,采集弹性图像,测量肿瘤最大直径,以Q-Box获取肿瘤弹性模样值E(kPa):平均值(Emean)、标准差(SD)及与周围正常乳腺组织弹性模量比值(Ratio),重复测量3次,取均值。待SWE图像采集完成后,切换至SMI模式,调节取样框大小调整速度,控制于1.2cm/s左右。选择血流显示最丰富切面分别采集彩色模式(cSMI)、灰阶模式(mSMI)图像。
血流分级标准[3]:以病灶内未发现血流信号为0级;病灶内存在少量血流,可见1或2细短棒状或点状血管为I级;病灶内存在中量血流,可见3或4个点状或1支较长血管,血管长度超过或接近病灶半径为II级;病灶内存在多量血流,可见2支较长血管或5个以上点状血管病灶为III级。通常认为,血流0~I级为良性肿瘤,血流II~III级为恶性肿瘤。
1. 3 观察指标
(1)对比乳腺良恶性肿瘤弹性模量值。(2)对比乳腺良恶性肿瘤mSMI血流分型对比。(3)以ROC曲线分析SMI联合SWE诊断效能。
1. 4 统计学方法
采用SPSS24.0分析数据,计量资料用(xˉ±s)表示,t检验,计数资料用n(%)表示,χ2检验,等级资料采用Ridit检验,检验水准α=0.05。
2、 结果
2. 1 弹性模量值
乳腺恶性肿瘤Emean、Ratio 及SD均较乳腺良性肿瘤高( P < 0. 05) 。见表1。
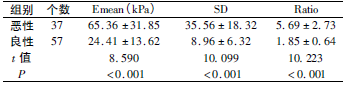

表1 乳腺良恶性肿瘤弹性模量值对比( xˉ±s)
2. 2 mSMI 血流分型
乳腺恶性肿瘤mSMI血流分型多集中于II~III级,良性肿瘤多集中于0~I级。乳腺恶性肿瘤mS-MI血流分型相比,差异有统计学意义(P<0.05)。见表2。
![表2 乳腺良恶性肿瘤mSMI血流分型对比[n( %) ]_文章发表](https://www.xrqkw.com/uploadfile/2020/0613/20200613054646361.png)
表2 乳腺良恶性肿瘤mSMI血流分型对比[n( %) ]
2. 3 ROC 曲线分析结果
SMI、SWE联合诊断敏感度、特异度均高于SMI、SWE单一诊断敏感度、特异度,联合诊断AUC大于单一诊断AUC。见表3。
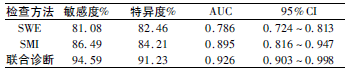
表3 SMI、SWE 单一及联合诊断效能
3、讨论
近年来,超声检查凭借其无辐射、无创、可实时观察等优势广泛应用于临床。乳腺良恶性肿瘤具有不同病理形态及组织学变异,超声检查可清晰显示其内层结构,区分病灶囊实性,并可评估病灶硬度,从而反映其特性及内部病理结构[4]。SWE作为一种定量评价组织硬度的新型弹性成像技术,目前已广泛应用于乳腺癌肿瘤良恶性判定中,具有客观、可重复性好的优势。研究表明,乳腺内不同组织弹性值不同,通常情况下,恶性肿瘤质地较硬,良性肿瘤相对较软,乳腺弹性值检测对乳腺病灶性质鉴别诊断具有重要价值[5]。本研究中乳腺恶性肿瘤Emean、Ratio及SD均高于对照组,提示乳腺恶性肿瘤弹性模量值较大,分析原因,可能是由于恶性肿瘤组织相对较硬,内部成分较为复杂,而良性肿瘤内部成分单一,质地相对较软,加之恶性肿瘤易侵袭周围正常组织,降低周围组织弹性,增加其硬度。
血管生成为肿瘤生长及转移的前提与基础。SMI作为一种基于多普勒原理的新技术,具有空间分辨率高、显示极低血流、高帧频成像、运动伪像少等优势,可于无需造影情况下对病变微血管成像。研究表明,SMI可分析杂波运动特性,且可通过全新自适应算法识别、消除组织本身运动,呈现更为真实血流信息,对于管径>0.1mm的低速微小血管均可显示[6]。本研究中乳腺恶性肿瘤mSMI血流分型多集中于II~III级,分析原因,可能是由于恶性肿瘤内1支或几支粗大扭曲血管伸入,考虑为滋养动脉,且恶性肿瘤体积较大时会形成丰富血管网,故其微细血管呈弥漫型分布;良性肿瘤多集中于0~I级,可能与其良性肿瘤新生血管较少、边缘包膜形成有关,供应血管多位于边缘或受压呈环绕生长。乳腺恶性肿瘤mSMI血流分型相比,差异有统计学意义(P<0.05),充分说明SMI可通过乳腺肿瘤血流分型鉴别其性质。此外,ROC曲线分析结果显示,SMI、SWE联合诊断AUC大于单一诊断AUC,充分说明SMI联合SWE鉴别诊断乳腺肿瘤良恶性,可进一步提高诊断效能。原因在于SWE根据病灶组织硬度判定乳腺肿瘤性质,而SMI通过血流分型鉴别乳腺肿瘤性质,二者联合诊断时,可协同合作,进一步提高诊断准确度。
综上所述,SMI联合SWE鉴别诊断乳腺肿瘤良恶性,可相互补充,诊断效能较高,值得临床推广与应用。
参考文献:
[1]纪晓辉,岳秀红.超声光散射成像联合实时剪切波弹性成像技术在乳腺良恶性肿物中的诊断价值[J].临床超声医学杂志,2016,18(2):127-129
[2]马燕,李晶,任卫东,等.超微血管成像与乳腺肿瘤微血管密度的相关性研究[J].临床与病理杂志,2016,36(4):364-369
[3]范向阳,李紫瑶,申凯凯,等.剪切波弹性成像联合超微血管显像在乳腺肿块良恶性鉴别诊断中的应用[J].中华超声影像学杂志,2016,25(9):795-799
[4]何玉霜,彭玉兰,金亚,等.实时剪切波弹性成像联合超声BI-RADS诊断乳腺癌的Meta分析[J].西部医学,2016,28(4):505-510
[5]林武辉,何立红,黎见,等.实时剪切波弹性成像鉴别乳腺肿瘤良恶性的初步探讨[J].中国中西医结合影像学杂志,2016,14(3):263-265
[6]纪欢,张蕾,李守强,等.剪切波弹性成像联合超微血管显像在甲状腺肿块良恶性鉴别诊断中的应用[J].中华超声影像学杂志,2018,27(2):143-146
相关热词搜索:
 官方微信
官方微信

 官方QQ
官方QQ













